# SARS-CoV-2, COVID-19, salive, kit de diagnostic
abstrait
rapide et précis SARS-CoV-2 tests diagnostiques est essentiel pour contrôler le COVID-19 pandémie. L'étalon-or actuel pour COVID-19 le diagnostic est en temps réel RT-PCR détection de SARS-CoV-2 de écouvillons nasopharyngés la faible sensibilité, les risques d'exposition pour les travailleurs de la santé et la pénurie mondiale d'écouvillons et d'équipements de protection individuelle nécessitent cependant la validation de nouvelles approches de diagnostic. la salive est un candidat prometteur pour SRAS-CoV-2 diagnostic parce que (1) la collecte est peu invasive et peut être auto-administrée et (2) la salive a montré une sensibilité comparable aux prélèvements nasopharyngés dans la détection d'autres agents pathogènes respiratoires, y compris les coronavirus humains endémiques, dans des études précédentes. À valider l'utilisation de la salive pour SRAS-CoV-2 détection, nous avons testé des échantillons de nasopharynx et de salive de confirmé COVID-19 patients et échantillons auto-collectés travailleurs de la santé sur COVID-19 salles. Quand nous avons comparé SARS-CoV-2 détection de adapté aux patients nasopharyngée
et des échantillons de salive, nous avons constaté que la salive offrait une plus grande sensibilité et cohérence de détection tout au long de l'infection. De plus, nous rapportons moins de variabilité dans auto-échantillon collection de salive. pris ensemble, nos résultats démontrent que la salive est une alternative viable et plus sensible aux écouvillons nasopharyngés et pourrait activer à domicile auto-administré prélèvement d'échantillons pour une grande précision SARS-CoV-2 test.
introduction
efforts pour contrôler le SRAS-CoV-2, le nouveau coronavirus causant COVID-19 pandémie, dépendent de tests de diagnostic précis et rapides. Ces les tests doivent être ( 1 ) sensibles aux infections légères et asymptomatiques pour favoriser un auto-isolement efficace et réduire la transmission au sein des groupes à haut risque ; ( 2 ) cohérent pour surveiller de manière fiable la progression de la maladie et faciliter les décisions cliniques ; et ( 3 ) évolutif pour informer les politiques de santé publique locales et nationales, comme quand les mesures de distanciation sociale peuvent être assouplies en toute sécurité Cependant, le SARS-CoV-2 les stratégies de test échouent souvent critères, en partie parce que de leur utilisation des écouvillons nasopharyngés comme type d'échantillon largement recommandé pour la RT-PCR en temps réel.
Bien que les écouvillons nasopharyngés sont couramment utilisés dans le diagnostic des virus respiratoires, ils présentent une sensibilité relativement faible pour SRAS-CoV-2 détection précoce de l'infection et sont 2–6 incohérent pendant tests en série . De plus, la collecte d’écouvillons nasopharyngés provoque une gêne pour les patients en raison de la procédure envahissant, limitant la conformité aux tests répétés, et présente un risque considérable pour les travailleurs de la santé, parce que il peut inciter les patients à éternuer ou à tousser, expulsant le virus particules7 . La procédure n'est pas non plus propice à des tests à grande échelle, parce que il existe une pénurie généralisée d'écouvillons et d'équipements de protection individuelle pour les travailleurs de la santé8 , et auto-collecte des prélèvements nasopharyngés est difficile et moins sensible pour la détection des virus9 . Ces Les défis seront encore exacerbés à mesure que le COVID-19 la pandémie s'intensifie dans les pays à faible revenu. compte tenu des limites, un système plus fiable et moins gourmand en ressources méthode de prélèvement d'échantillons, idéalement une méthode permettant auto-collecte à la maison, est un besoin urgent le prélèvement de salive est une alternative intéressante au prélèvement nasopharyngé, depuis la collecte de la salive est non invasive et facile à auto-administrer. une analyse de la concordance nasopharyngée et salivaire pour RT-PCR détection d'agents pathogènes respiratoires, dont deux saisonniers
coronavirus humains, suggère une sensibilité diagnostique comparable entre les deux échantillons 10,11de COVID-19 patients et ( 2 ) les échantillons de salive auto-collectés sont comparables. les résultats préliminaires indiquent que ( 1 ) SARS-CoV-2 peut être détecté de la salive 12 typesmSARS-CoV-2 sensibilité de détection aux écouvillons nasopharyngés prélevés par les soins de santé 13travailleurs de léger et subclinique COVID-19 cas . Mais il est essentiel qu'aucune évaluation rigoureuse de la sensibilité du SRAS-CoV-2 détection dans la salive des prélèvements nasopharyngés de patients hospitalisés pendant le cours de COVID-19 infection.
dans cette étude, nous avons évalué SARS-CoV-2 détection dans des écouvillons nasopharyngés appariés et des échantillons de salive prélevés de COVID-19 patients hospitalisés et travailleurs de la santé asymptomatiques à moyenne à élevée risque de COVID-19 exposition. Notre Les résultats indiquent que l'utilisation de la salive pour SRAS-CoV-2 la détection est plus sensible et cohérente que en utilisant des écouvillons nasopharyngés Dans l'ensemble, nous démontrons que la salive devrait être considéré comme un type d'échantillon fiable pour atténuer COVID-19 tests demandes.
résultats
supérieur SARS-CoV-2 titres détectés de salive que écouvillons nasopharyngés de patients hospitalisés
À déterminer si la salive fonctionne aussi bien que les États-Unis. recommandation du CDC d'utiliser des écouvillons nasopharyngés pour SARS-CoV-2 diagnostics, nous avons prélevé des échantillons cliniques de 44 COVID-19 participants à l'étude en milieu hospitalier ( Tableau 1 ). Ceci cohorte représente une gamme de COVID-19 patients atteints d'une maladie grave, avec 19 (43%) nécessitant des soins intensifs, 10 (23%) nécessitant une ventilation mécanique, et 2 (5%) décédé le 5 avril 2020. en utilisant les États-Unis cdc SARS-CoV-2 RT-PCR test, nous avons testé 121 salive ou soins de santé auto-collectés écouvillons nasopharyngés de cette cohorte. Nous trouvé une forte concordance entre les États-Unis. cdc «N1» et «N2» amorce-sonde ensembles ( données étendues Fig. 1), et ainsi calculé les titres viraux (virus copies / mL) en utilisant uniquement le «N1» ensemble. De tous les échantillons positifs testés ( n = 46 nasopharyngée, 37 salive), nous avons trouvé que les titres viraux moyens géométriques de salive étaient environ 5⨉ supérieur que écouvillons nasopharyngés ( p < 0,05 Mann-Whitney test; Fig. 1a ). Quand en limitant notre analyse à seulement patient-apparié échantillons de nasopharynx et de salive ( n = 38 pour chaque type d'échantillon), nous avons constaté que SARS-CoV-2 titres de la salive était significativement plus élevée que écouvillons nasopharyngés ( p = 0,0001, Wilcoxon test; Fig. 1b ). De plus, nous avons détecté SARS-CoV-2 de la salive mais pas les écouvillons nasopharyngés de huit échantillons correspondants (21%), alors que nous n'avons détecté que SARS-CoV-2 de écouvillons nasopharyngés et non salive de trois échantillons appariés (8%; Fig. 1c ). Dans l'ensemble, nous avons trouvé un SRAS-CoV-2 titres de salive que écouvillons nasopharyngés de hôpital patients hospitalisés.
tableau 1. COVID-19 caractéristiques de la cohorte de patients hospitalisés
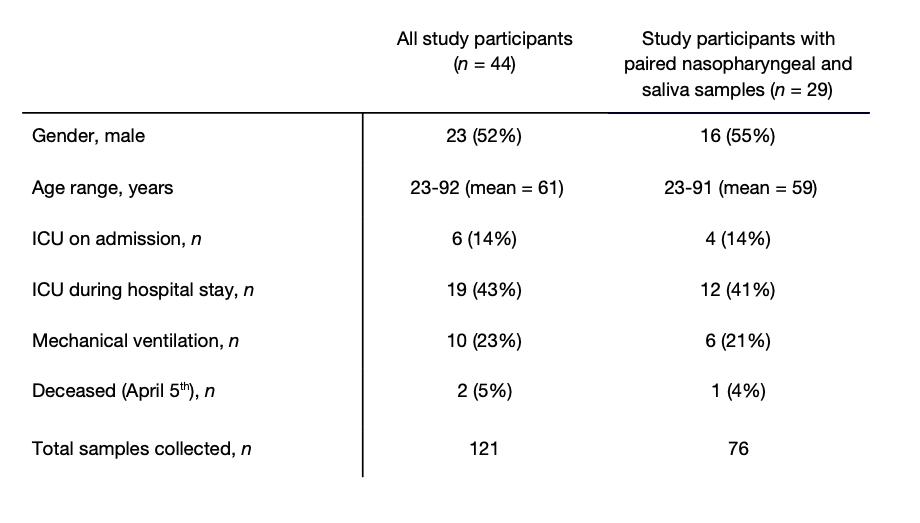
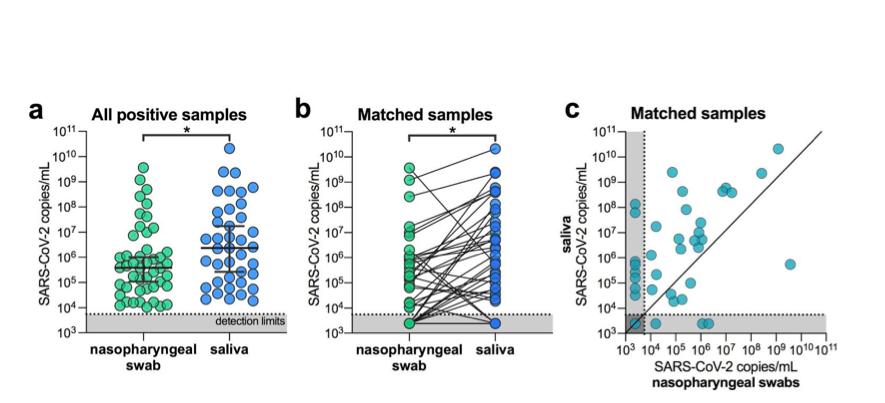
chiffre 1. SARS-CoV-2 les titres sont plus élevés dans la salive que écouvillons nasopharyngés de hôpital patients hospitalisés. ( une ) tous les écouvillons nasopharyngés positifs ( n = 46) et échantillons de salive ( n = 39) ont été comparés par un Mann-Whitney test ( p < 0,05). les barres représentent la médiane et 95% CI. Notre limites de détection des tests pour SARS-CoV-2 en utilisant le cdc américain “N1” test est au seuil du cycle 38, ce qui correspond à 5 610 virus copies / mL de l'échantillon (affiché sous forme de ligne pointillée et de zone grise). ( b ) échantillons appariés aux patients ( n = 38), représentés par les lignes de connexion, ont été comparés par un Wilcoxon test test ( p < 0,05). ( c ) échantillons appariés aux patients ( n = 38) sont également représentés sur un nuage de points toutes les données utilisées pour générer ce chiffre, y compris les seuils de cycle brut, se trouvent dans données supplémentaires 1 . données étendues Fig. 1montre la corrélation entre nous test cdc «N1» et «N2» résultats.
moins temporel SARS-CoV-2 variabilité quand test de la salive de patients hospitalisés
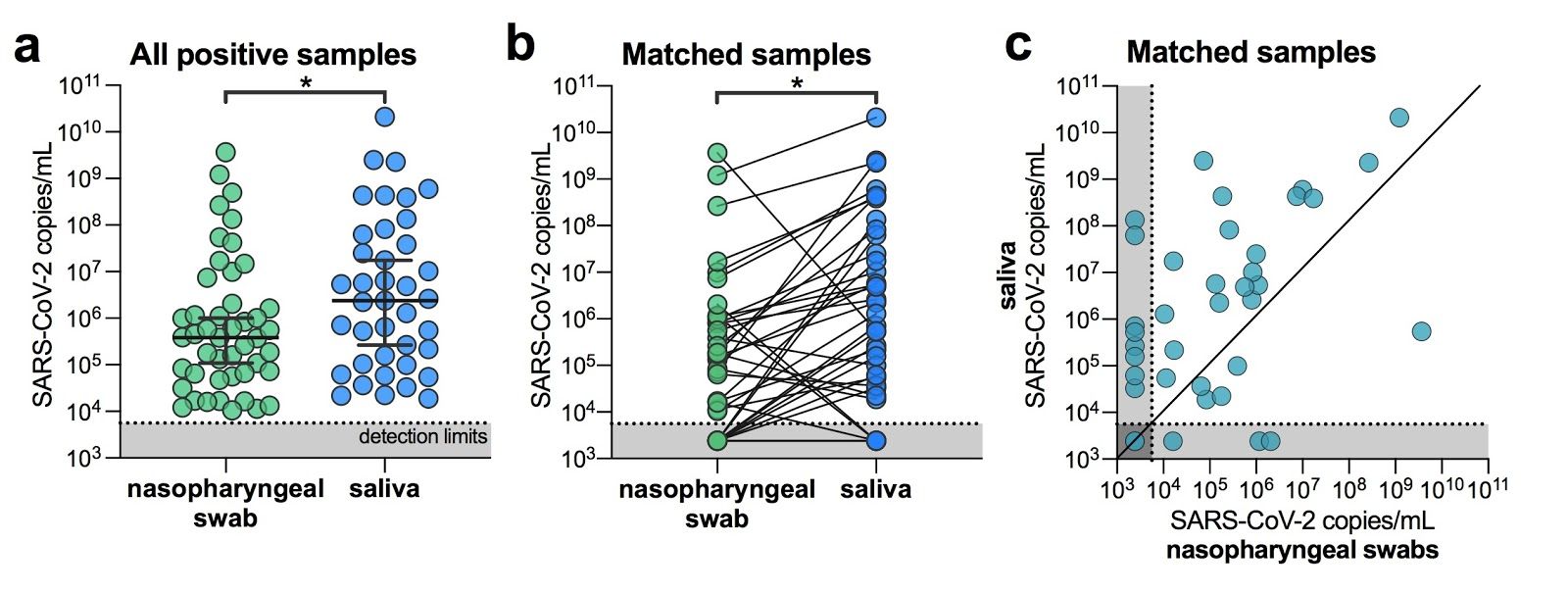
comme temporel SARS-CoV-2 tests de diagnostic de les écouvillons nasopharyngés seraient 2,3variable, nous avons testé des échantillons longitudinaux du nasopharynx et de la salive de patients hospitalisés pour déterminer quel type d'échantillon a fourni des résultats plus cohérents. De 22 participants avec plusieurs écouvillons nasopharyngés et 12 participants avec plusieurs échantillons de salive, nous avons constaté que SARS-CoV-2 les titres ont généralement diminué dans les deux types d'échantillons après la date déclarée de l'apparition des symptômes ( Fig. 2a ). Notre Les résultats des prélèvements nasopharyngés concordent avec 2,3rapports précédents de la variable SARS-CoV-2 titres et résultats : nous avons trouvé 5 instances où un participant L'écouvillon nasopharyngé était négatif pour SRAS-CoV-2 suivi d'un résultat positif pendant la collection suivante (5 / 33 répète, 33%; Fig. 2b ) . dans les collections longitudinales de salive de 12 patients, cependant, il n'y a eu aucun cas dans lequel un échantillon a été testé négatif et a ensuite été suivi d'un résultat positif. comme les résultats de test vraiment négatifs sont importants pour les cliniciens pour suivre les améliorations des patients et pour les décisions concernant les sorties, nos données suggèrent que la salive est un type d'échantillon plus cohérent écouvillons nasopharyngés pour surveiller les changements temporels du SRAS-CoV-2 titres.
chiffre 2: SARS-CoV-2 la détection est moins variable entre les prélèvements répétés d'échantillons avec salive. (a) longitudinal SRAS-CoV-2 titres de les prélèvements de salive ou de rhinopharynx sont indiqués en jours depuis symptôme apparition. chaque cercle représente un échantillon séparé, qui sont connectés à des échantillons supplémentaires de le même patient par une ligne en tirets. Notre limites de détection des tests pour SARS-CoV-2 en utilisant le cdc américain “N1” test est au seuil du cycle 38, ce qui correspond à 5 610 virus copies / mL de l'échantillon (affiché sous forme de ligne pointillée et de zone grise). ( b ) Les données sont également présentées par moment d'échantillonnage (séquentiel collection temps) pour mettre en évidence les différences de titres de virus entre les points de collecte. toutes les données utilisées pour générer ce chiffre, y compris les seuils de cycle brut, se trouvent dans données supplémentaires 1 .
plus cohérent auto-échantillonnage de travailleurs de la santé utilisant de la salive
valider la salive pour la détection de SARS-CoV-2 infections pourrait prouver transformatif pour le diagnostic à distance des patients et la surveillance des professionnels de la santé. À enquêter sur cela, nous avons recruté 98 travailleurs de la santé asymptomatiques notre étude et collecté la salive et / ou écouvillons nasopharyngés en moyenne tous les 2,9 jours (intervalle = 1-8 jours, Tableau 2 ). À date, nous avons détecté SARS-CoV-2 dans la salive de deux agents de santé qui ont été négatifs par des prélèvements nasopharyngés utilisant à la fois le CDC américain «N1» et «N2» tests et n'a signalé aucun symptôme. La salive de un de ces individus ont de nouveau été testés positifs à côté d'un écouvillon nasopharyngé négatif correspondant sur répéter le test 2 jours plus tard. titres de virus de soins de santé asymptomatiques travailleurs la salive est inférieure à quoi nous détectons généralement de patients hospitalisés symptomatiques ( Fig. 3a ), qui soutient probablement l'absence de symptômes.
Notre des données limitées soutiennent que la salive peut être plus sensible pour la détection asymptomatique ou pré-symptomatique infections; cependant, une plus grande taille d'échantillon est nécessaire pour confirmer. car l'incohérence de l'échantillonnage sur écouvillon nasopharyngé peut être l'un des problèmes potentiels des faux négatifs ( Fig. 2), la surveillance d'un contrôle interne pour un prélèvement d'échantillons correct, la rnase P humaine, peut fournir une autre technique d'évaluation. tandis que la détection de la rnase p humaine était meilleure de salive dans les cohortes d'hospitalisés et d'agents de santé ( Fig. 3b ) , cela seul peut ne pas indiquer une meilleure détection des virus. plus important encore, nous avons constaté que la détection de la rnase p humaine était plus variable de écouvillons nasopharyngés prélevés de patients hospitalisés ( p = 0,0001, test f pour variances) et auto-collectées de travailleurs de la santé ( p = 0,0002; Fig. 3b ). Notre Les résultats suggèrent que la salive peut également être une alternative appropriée, et peut-être plus sensible, aux écouvillons nasopharyngés pour le dépistage asymptomatique ou pré-symptomatique SARS-CoV-2 infections.
tableau 2. cohorte de travailleurs de la santé

chiffre 3. la salive est une alternative au SRAS-CoV-2 dépistage de travailleurs de la santé et cas asymptomatiques. ( une ) SARS-CoV-2 titres mesurés à partir de la salive des travailleurs de la santé et des patients hospitalisés. Notre limites de détection des tests pour SARS-CoV-2 en utilisant le cdc américain “N1” test est au seuil du cycle 38, ce qui correspond à 5 610 virus copies / mL de l'échantillon (affiché sous forme de ligne pointillée et de zone grise). ( b ) RT-PCR seuils de cycle (Ct) valeurs pour la rnase P humaine et contrôle interne pour la collecte d'échantillons, de soit patients hospitalisés (gauche panneau) ou les travailleurs de la santé (à droite panneau) ont été comparés par variances en utilisant le test f ( p = 0,0001 pour patients hospitalisés; p = 0,0002 pour les travailleurs de la santé). toutes les données utilisées pour générer ce chiffre, y compris les seuils de cycle brut, se trouvent dans données supplémentaires 1 .
discussion
Notre étude démontre que la salive est une alternative viable et préférable aux écouvillons nasopharyngés pour SRAS-CoV-2 détection. Nous ont constaté que la sensibilité de SARS-CoV-2 détection de la salive est comparable, sinon supérieure aux prélèvements nasopharyngés en début d'hospitalisation et est plus constante pendant hospitalisation et rétablissement prolongés. De plus, la détection de SARS-CoV-2 de la salive de deux agents de santé asymptomatiques malgré des prélèvements nasopharyngiens appariés négatifs suggère que la salive peut également être une alternative viable pour identifier les infections légères ou subcliniques. Avec validation supplémentaire, mise en œuvre généralisée de l'échantillonnage de la salive pourrait être transformateur pour la santé publique efforts: salive auto-collecte annule le besoin de soins directs travailleur-patient interaction, source de 14–16 plusieurs goulots d'étranglement majeurs dans les tests et le risque global d'infection nosocomiale, et allège la demande d'approvisionnement en écouvillons et équipements de protection individuelle.
AsSARS-CoV-2viralloadsdifferb betweenmildetseverecases , une limite de notre étude est le principal objectif de COVID-19 patients hospitalisés, dont beaucoup souffrent de maladie grave. alors que davantage de données sont nécessaires pour comparer plus rigoureusement l'efficacité de la salive en milieu hospitalier à un stade précoce de l'infection, les résultats de deux études récentes confirment son potentiel 13,18 détection SARS-CoV-2 de à la fois les personnes asymptomatiques et les patients ambulatoires . comme 12 un virus infectieux a été détecté de la salive de COVID-19 patients, en vérifiant la relation entre les copies du génome viral et les particules virales infectieuses dans la salive de 19 pré-symptomatique les individus joueront un rôle clé dans la compréhension de la dynamique 1,20transmission asymptomatique.
provenant de les résultats prometteurs pour SARS-CoV-2 détection dans asymptomatique 13
individus, le test de détection ASALIVALSARS-CoV-2 a déjà obtenu l'approbation
nous. autorisation d'utilisation d'urgence pour l'administration des aliments et des médicaments . À répondre aux demandes croissantes de tests, cependant, nos résultats appuient la nécessité d'une validation et d'une mise en œuvre immédiates de la salive pour SARS-CoV-2 diagnostics dans des laboratoires cliniques certifiés.
méthodes
éthique
tous les participants à l'étude ont été inscrits et échantillonnés conformément à l'université de yale HIC-approuvé protocole # 2000027690. Les données démographiques, les données cliniques et les échantillons n'ont été collectés qu'après que le participant à l'étude ait reconnu qu'ils avait compris le protocole de l'étude et signé le consentement éclairé. toutes les informations sur les participants et les échantillons ont été collectés en association avec les identifiants des études.
inscription des participants
patients hospitalisés
patients admis à l'hôpital de yale new havre (a 1541 lits centre médical de soins tertiaires à new Haven, CT, USA), qui ont été testés positifs pour SRAS-CoV-2 par nasopharynx et / ou écouvillon oropharyngé (test approuvé par les CDC) ont été invités à s'inscrire à la recherche étude. les critères d'exclusion étaient l'âge de moins de 18 ans, non-anglais oraux et preuves cliniques, radiologiques ou de laboratoire d'un non infectieux cause de fièvre ou de symptômes respiratoires ou confirmée microbiologiquement source infectieuse (par exemple gastro-intestinale, urinaire, cardiovasculaire) autre que voies respiratoires pour les symptômes et aucune suspicion pour COVID-19 infection.
Les travailleurs du domaine de la santé
travailleurs de la santé asymptomatiques (par exemple, sans fièvre ni symptômes respiratoires) avec exposition professionnelle aux patients atteints de COVID-19 ont été invités à s'inscrire à l'étude. la participation à l'étude a permis une surveillance active pour assurer une détection précoce après une exposition et pour protéger davantage les autres agents de santé et les patients.
collecte d'échantillons
patients hospitalisés
des échantillons de rhinopharynx et de salive ont été prélevés tous les trois jours clinique cours. des échantillons de rhinopharynx ont été prélevés par des infirmières autorisées utilisant le transport viral universel bd (UVT) système. Le flexible, mini-pointe écouvillon a été passé à travers narine jusqu'à le nasopharynx postérieur a été atteint, laissé en place pendant plusieurs secondes pour absorber les sécrétions puis retiré lentement en rotation. L'écouvillon a été placé dans le milieu de transport viral stérile (total volume 3 mL) et scellé solidement. des échantillons de salive ont été auto-collectés par le patient. Sur au réveil, on a demandé aux patients d'éviter la nourriture, l'eau et le brossage des dents jusqu'au l'échantillon a été recueilli. les patients ont été invités à cracher à plusieurs reprises into une tasse d'urine stérile jusqu'à environ un tiers plein de liquide (à l'exclusion des bulles), avant de le refermer en toute sécurité. tous les échantillons ont été conservés à température ambiante et transportés au laboratoire de recherche de l'école de santé publique de yale dans les 5 heures suivant le prélèvement des échantillons.
Les travailleurs du domaine de la santé
les travailleurs de la santé ont été invités à collecter un écouvillon nasopharyngé et un échantillon de salive tous les trois jours pendant une période de 2 semaines. les échantillons ont été conservés à + 4 ° C jusqu'à transporté au laboratoire de recherche.
SARS-CoV-2 détection
à l'arrivée au laboratoire de recherche, total nucléique l'acide a été extrait de 300 μl des supports de transport viral de l'écouvillon nasopharyngé ou 300 μl de salive entière à l'aide du MagMAX Viral / Pathogène Nucléique kit d'isolation acide (ThermoFisher Scientific) suivant le fabricant protocole et élue en 75 μl d'élution tampon. Pour SARS-CoV-2 ARN 21,22 détection, 5 μl du modèle ARN a été testé comme décrit précédemment, en utilisant le RT-PCR amorce / sonde ensembles pour 2019-nCoV_N1 et 2019-nCoV_N2 et la rnase humaine p (RP) comme un contrôle d'extraction. échantillons ont été classés comme positifs pour SRAS-CoV-2 quand les deux N1 et N2 amorce-sonde ensembles ont été détectés <38 c . les copies de virus étaient t quantifié en utilisant un 10 fois courbe standard de dilution des transcriptions d'ARN que nous avons précédemment 21généré . comme résultats de N1 et N2 étaient comparables ( données étendues Fig. 1), toutes les copies de virus sont affichées comme calculées à l'aide de N1 amorce-sonde ensemble.
analyses statistiques
des analyses statistiques ont été menées dans GraphPad prisme 8.0.0 comme décrit dans les Résultats.
remerciements
Nous remercions chaleureusement les participants à l'étude pour leur temps et engagement pour l'étude. Nous remercier tous les membres de l'équipe clinique de Yale-New hôpital de refuge pour leur dévouement et travail qui ont rendu cette étude Nous merci aussi S. taylor et P. jack pour discussions techniques.
financement
L'étude a été partiellement financée par l'institut yale pour la santé mondiale. Les auteurs correspondants avaient un accès complet à toutes les données de l'étude et avaient la responsabilité finale de la décision de soumettre pour publication.
données étendues
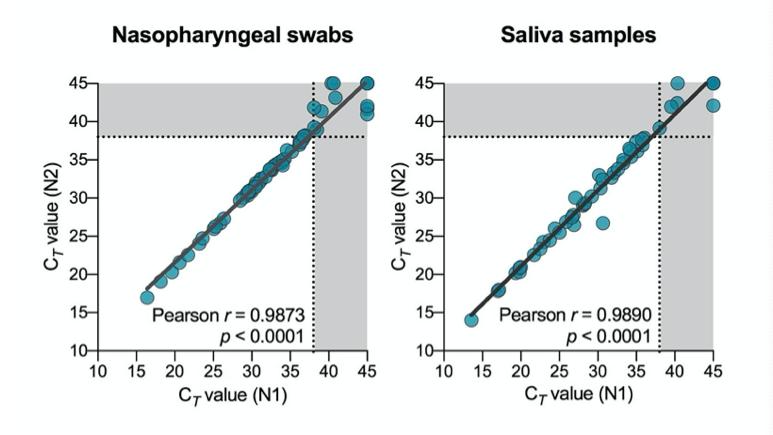
données étendues Fig. 1. concordance entre SARS-CoV-2 détection en utilisant nous cdc “N1” et «N2» amorces et sondes ensembles. ct = RT-PCR cycle seuil. Les lignes pointillées et les zones grises indiquent les limites de détection.
références
1. Kimball, A. et al. asymptomatique et présymptomatique SRAS-CoV-2 infections chez les résidents d'un établissement de soins infirmiers de longue durée - King County, Washington, mars 2020. MMWR Morb. Mortel. Wkly. Rép. 69, 377–381 (2020).
2. Wölfel, R. et al. évaluation virologique des patients hospitalisés avec COVID-2019. la nature (2020) doi: 10.1038 / s41586-020-2196-x.
3. Zou, L. et al. SARS-CoV-2 charge virale dans les échantillons des voies respiratoires supérieures Patients infectés. N. Engl. J. Med. 382 , 1177–1179 (2020).
4. Zhao, J. et al. réponses anticorps contre SRAS-CoV-2 chez les patients de nouveau coronavirus maladie 2019. Clin. Infect. Dis. (2020) doi: 10.1093 / cid / ciaa344.
5. Xie, X. et al. poitrine ct typique 2019-nCoV Pneumonie: relation avec le négatif RT-PCR Test. radiologie 200343 (2020).
6. Wang, W. et al. détection de SARS-CoV-2 dans différents types de spécimens cliniques JAMA (2020) doi: 10.1001 / jama.2020.3786.
7. À, K. K.-W. et al. profils temporels de la charge virale dans les échantillons de salive oropharyngée postérieure et réponses des anticorps sériques pendant infection par SRAS-CoV-2: une étude de cohorte d'observation. lancette Infect. Dis. (2020) doi: 10.1016 / S1473-3099 (20) 30196-1.
8. CDC. recommandations provisoires de prévention et de contrôle des infections pour les patients suspects ou confirmés de Coronavirus maladie 2019 (COVID-19) dans les soins de santé Paramètres. Centres pour le Contrôle et la Prévention des catastrophes https: / / www.cdc.gov / coronavirus / 2019-ncov / hcp / infection-control-recommendations.h tml? CDC_AA_refVal = https% 3A% 2F% 2Fwww.cdc.gov% 2Fcoronavirus% 2F2019-ncov % 2Finfection-control% 2Fcontrol-recommendations.html (2020).
9. Dhiman, N. et al. efficacité des écouvillons pour tests de grippe. mayo Clin. Proc. 87, 548–554 (2012).
10. Kim, Y.-G. et al. comparaison entre les échantillons de salive et d'écouvillons nasopharyngés pour la détection des virus respiratoires par multiplex inverse Transcription-PCR. J. Clin. Microbiol. 55, 226–233 (2017).
11. Wyllie, A. L. et al. surveillance moléculaire du portage nasopharyngé du streptocoque pneumoniae chez les enfants vaccinés avec des vaccins antipneumococciques polysaccharidiques conjugués. Sci. Rép. 6, 23809 (2016).
12. À, K. K.-W. et al. détection cohérente de 2019 roman Coronavirus dans Salive. Clin. Infect. Dis. (2020) doi: 10.1093 / cid / ciaa149.
13. Kojima, N. et al. Les écouvillons de liquide oral et nasal auto-collectés démontrent une sensibilité comparable aux écouvillons nasopharyngés prélevés par un clinicien pour Covid-19 Détection. medRxiv 2020.04.11.20062372 (2020).
14. Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L. & Conly, J. procédures génératrices d'aérosols et risque de transmission d'infections respiratoires aiguës aux travailleurs de la santé une revue systématique plos un sept, e35797 (2012).
15. Judson, S. D. & Munster, V. J. transmission nosocomiale de virus émergents via Générateur d'aérosols médical Procédures. virus 11, (2019).
16. Wang, D. et al. caractéristiques cliniques de 138 patients hospitalisés Avec 2019 roman infecté par le coronavirus pneumonie à Wuhan, Chine. JAMA (2020) doi: 10.1001 / jama.2020.1585.
17. Liu, Y. et al. dynamique virale dans les cas légers et graves de COVID-19. lancette Infect. Dis. (2020) doi: 10.1016 / S1473-3099 (20) 30232-2.
18. nous. nourriture & médicament Administration. autorisation d'utilisation d'urgence accélérée (EUA) résumé SARS-CoV-2 test (Rutgers génomique clinique Laboratoire). https: / / www.fda.gov / media / 136875 / télécharger.
19. Lauer, S. A. et al. La période d'incubation du Coronavirus maladie 2019 (COVID-19) De confirmé publiquement Cas: estimation et Application. Ann. Stagiaire. Med.
Source: https: / / www.medrxiv.org / contenu / 10.1101 / 2020.04.16.20067835v1.full.pdf
AnneL.Wyllie1 *, JohnFournier2, ArnauCasanovas-Massana1, MelissaCampbell2, MariaTokuyama3, Pavithra Vijayakumar4 , Bertie Geng4 , M. catherine Muenker1 , adam J. Moore1 , Chantal B.F. Vogels1 , marie E. Petrone1 , Isabel M. Ott5, Peiwen Lu3 , Arvind Venkataraman3 , Alice Lu-Culligan3 , jonathan Klein3 , rebecca Earnest1 , michael Simonov6 , Rupak Datta2 , Ryan Handoko2 , Nida Naushad2 , Lorenzo R. Sewanan2 , Jordanie Valdez2 , elizabeth B. Blanc1 , sarah Lapidus1 , Chaney C. Kalinich1 , Xiaodong Jiang3 , daniel J. Kim3 , Eriko Kudo3 , mélisse Linehan3 , Tianyang Mao3 , Miyu Moriyama3 , ji Eun Oh3 , Annsea Park3 , Julio Silva3 , Eric Song3 , Takehiro Takahashi3 , Manabu Taura3 , Orr-El Weizman3 , patrick Wong3 , Yexin Yang3 , santos Bermejo7 , Camila Odio8 , Saad B. Omer1,2,9,10, charles S. Dela Cruz7 , ShelliFarhadian2, RichardA.Martinello2,7,11, AkikoIwasaki3,12, NathanD.Grubaugh1 # *, AlbertI.Ko1 # *
1 département d'épidémiologie des maladies microbiennes, Yale School of Public Health, New Haven, CT 06510, USA 2 Department of Medicine, section of infectious Diseases, Yale School of Medicine, New Haven, CT, 06510, USA
3 Département d'immunobiologie, Yale School of Medicine, New Haven, CT, 06510, États-Unis
4 Département d'obstétrique, de gynécologie et des sciences de la reproduction, Yale School of Medicine, New Haven, CT, 06510, USA
5 Département d'écologie et de biologie évolutive, Université de Yale, New Haven, CT 06520, États-Unis
6 programme de recherche translationnelle appliquée, Yale School of Medicine, New Haven, CT, 06510, USA
7 Département de médecine interne, section de la médecine pulmonaire, critique et du sommeil, Yale School of Medicine, New Haven, CT, 06510, USA
8 département de médecine, groupe médical du nord-est, Yale-New Haven Health, New Haven, CT 06510, États-Unis
9 Yale Institute of Global Health, New Haven, CT 06510, États-Unis
10 Yale School of Nursing, New Haven, CT 06510, États-Unis
11 département de prévention des infections, Yale-New Haven Health, New Haven, ct 06520
12 Howard Hughes Medical Institute, New Haven, CT 06510, États-Unis
# coauteurs principaux
* Correspondance: anne.wyllie@yale.edu (ALW); nathan.grubaugh@yale.edu (NDG); albert.ko@yale.edu (AIK)